Digitale Ausgabe
Download
| TEI-XML (Ansicht) | |
| Text (Ansicht) | |
| Text normalisiert (Ansicht) |
Ansicht
| Textgröße | |
| Originalzeilenfall ein/aus | |
| Zeichen original/normiert | |
Abbildungen
Zitierempfehlung
Alexander von Humboldt: „Versuche über die chemische Zerlegung des Luftkreises“, in: ders., Sämtliche Schriften digital, herausgegeben von Oliver Lubrich und Thomas Nehrlich, Universität Bern 2021. URL: <https://humboldt.unibe.ch/text/1799-Versuche_ueber_die-1> [abgerufen am 20.04.2024].
URL und Versionierung
|
Permalink: https://humboldt.unibe.ch/text/1799-Versuche_ueber_die-1 |
| Die Versionsgeschichte zu diesem Text finden Sie auf github. |
| Titel | Versuche über die chemische Zerlegung des Luftkreises | ||||
|---|---|---|---|---|---|
| Jahr | 1799 | ||||
| Ort | Halle | ||||
|
Nachweis in: Annalen der Physik 3:1 (1799), S. 77–90, Tafel.
|
|||||
|
Postumer Nachdruck Ludwig Achim von Arnim, Werke und Briefwechsel, Historisch-kritische Ausgabe, in Zusammenarbeit mit der Stiftung Weimarer Klassik und Kunstsammlungen herausgegeben von Roswitha Burwick, Lothar Ehrlich, Heinz Härtl, Renate Moering, Ulfert Ricklefs und Christof Wingertszahn, Tübingen: Niemyer 2007, Band 2, Naturwissenschaftliche Schriften 1, herausgegeben von Roswitha Burwick, S. 153–164.
|
|||||
|
Entsprechungen in Buchwerken „Beschreibung eines Absorbtions-Gefässes welches besonders als Kohlensäure-Messer gebraucht werden kann“ in: Alexander von Humboldt, Versuche über die chemische Zerlegung des Luftkreises und über einige andere Gegenstände der Naturlehre, Braunschweig: Vieweg 1799, S. 81–116.
|
|||||
| Sprache | Deutsch | ||||
| Typografischer Befund | Antiqua (mit lang-s); Auszeichnung: Kursivierung, Sperrung; Fußnoten mit Asterisken; Tabellensatz; Schmuck: Initialen; Formelsatz. | ||||
|
Identifikation |
|||||
Statistiken
|
|||||
VERSUCHE über die chemiſche Zerlegung des Luftkreiſes,von Alex. von Humboldt.
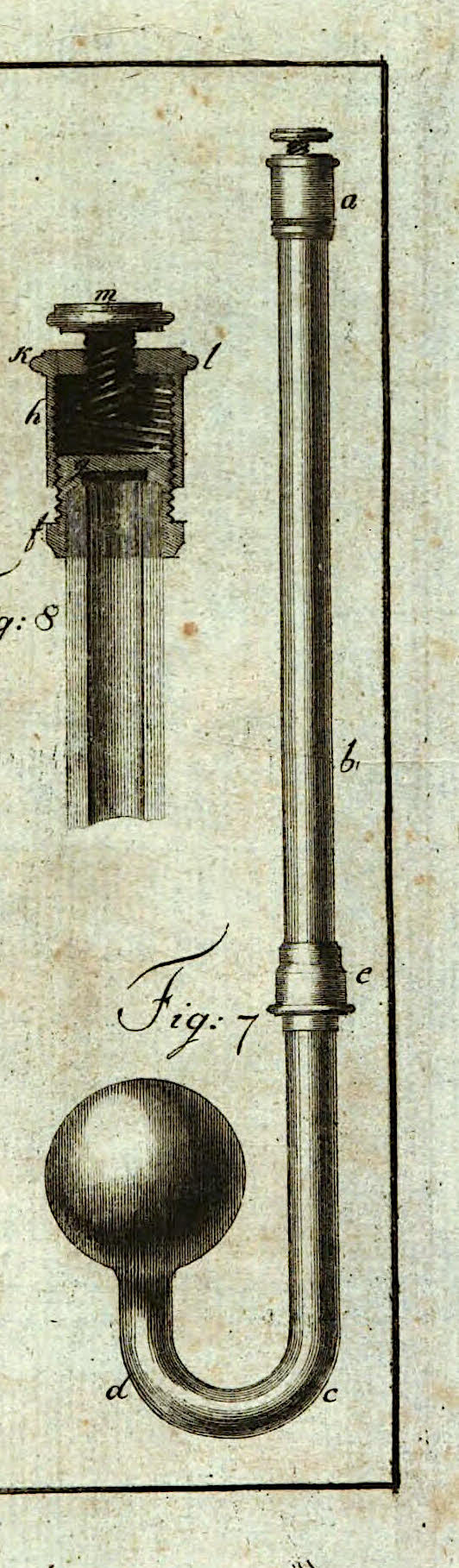
1. Beſchreibung eines Kohlenſäuremeſſers, (An-thracometer.)
2. Ueber die Kohlenſäure, welche im Dunſtkreiſeverbreitet iſt, und über die Beſchaffenheit desLuftkreiſes der gemäßigten Zone.
*) S. Gehler’s phyſ. Wörterbuch, B. 2, S. 396.**) Voy. dans les Alpes , T. 4, §. 2010, p. 200.|80| durch kohlenſtoffhaltige Flechten, (lichen ſulphu-reus und rupeſtris,) ſo wie weiter unten durchChloriterde und Hornblende hervorgebracht wird.In der Luft, die Garnerin *) aus einer Höhe von 650Toiſen mitbrachte, war eben ſo viel Kohlenſäure,wie damahls zu Paris. — Nach dieſen Erfahrungenſcheint die Kohlenſäure kein zufälliger, ſondern einallgemein verbreiteter Beſtandtheil der Atmoſphärezu ſeyn, vielleicht, daß wir auch noch Waſſerſtoff-gas mit dem Stickgas in derſelben verbunden ent-decken. Das Regenwaſſer zeigte ihm keine SpurKohlenſäure. Lange wiederhohlte Vergleichungdes Anthracometers mit dem Hygrometer habenzwar gezeigt, daß im Sommer im Ganzen etwasmehr Kohlenſäure in der Atmoſphäre iſt, daß aberdieſer Unterſchied keinesweges in den hygrometri-ſchen Verhältniſſen des Luftkreiſes gegründet iſt.Aus dieſen Verſuchen geht ebenfalls hervor, daßwir die nächſten Urſachen des zunehmenden undabnehmenden Kohlenſäuregehalts noch nicht zubeſtimmen im Stande ſind. Die Verſuche des Hrn v. Humboldt über dieBeſchaffenheit des Luftkreiſes der gemäßigten Zone,die er mit dem Eudiometer, dem Barometer, Ther-mometer, Electrometer, Anthracometer, dem Sauſ-ſüriſchen und de Lüc’s Hygrometer während 6Monate, täglich mehrere Mahle angeſtellt, könnenhier nicht in ihrem Umfange, ſondern nur in ihren
*) Siehe den Zuſatz.|81| Reſultaten mitgetheilt werden. Wer es weiß, wiewenig Genuß ſolche Verſuche gewähren, ehe eine ge-nugſame Menge derſelben geſammelt, wie ſorgfältigman ſelbſt alle vorſchnelle Vermuthungen zurückhal-ten muß, um nicht bei dieſer Beobachtung etwas zu-zugeben, bei jener etwas wegzulaſſen; der wirdſicher der unermüdeten Ausdauer des Herrn von Humboldts ſeine Bewunderung nicht verſagen. Die wichtigſten Reſultate, welche er aus jenenVerſuchen zieht, zeigen, daß, wenn bei trübem Wetterdie Dünſte ſich auflöſen, die Wolken verſchwindenund ſich des Himmels Gewölbe blau färbt, meiſtdie Sauerſtoffmenge des Luftkreiſes zunehme.Sie nimmt dagegen meiſt ab, wenn am blauen hei-tern Himmel das Cyanometer vom 20° bis 7° über-geht, und wenn Regen- oder Schneewolken ſich bil-den. Schlackiges Wetter, beſonders Hagel mit Schneegemiſcht, kündigt die geringſte Sauerſtoffmenge an.Beim Nebel mit ſtarker negativer Electricität, in-dem die Waſſerdünſte ſich auflöſen, iſt die Luft ſehrreich an Oxygen. Das Schmelzen des Schnees,bisweilen ſelbſt das Fallen eines großflockigen,leicht zergehenden Schnees, verbeſſert den Luft-kreis. Eine ähnliche Verbeſſerung wird häufig beiden im Frühjahre gewöhnlichen wohlriechendenStrichregen bemerkt, bei welchen die Electricitäthäufig aus der poſitiven in die negative übergeht.Die Verminderung bei der Bildung des Regensleitet der Verfaſſer aus einem Verſchluckendeſſelben durch das gebildete Waſſer her, oder |82| durch die Umhüllung der Dunſtbläschen durchoxygenreichere Atmoſphären. Das Maximum desSauerſtoffgehalts fand der Verf. 0,290 und dasMinimum 0,236; der mittlere Sauerſtoffgehalt warim November 0,256, im December 0,268, Januar0,275, Februar 0,272, März 0,269, April 0,272,und in allen ſechs Monaten 0,268. — Die electri-ſche Ladung des Luftkreiſes fand er ſtets poſitiv,(S. 174,) negativ war ſie nur auf einzelne Minu-ten. Es war mir dies eine willkommene Beſtätigungdeſſen, was ich in meinem Verſuche über die Theo-rie der electriſchen Erſcheinungen, S. 48, darübergeäußert habe. Bei ſehr tief ziehenden Wol-ken war die E meiſt 0. Beim Schneien aber be-merkte der Verf. oft denſelben Wechſel zwiſchen+ und — E, welchen Herr Lampadius beim Ge-witter wahrnahm. Am 5ten Februar war die E bei blauem wolkenfreien Himmel negativ. Amſtärkſten und am ſchnelleſten aus + in —, wechſeltſie im Nebel. Hagelwetter iſt anhaltend negativ. Herr von Buch hatte den ſinnreichen Gedan-ken, den Stand des Thermometers im Schatten undim Lichte zu beobachten. Es iſt merkwürdig, wie angleich heitern Tagen bei gleicher Himmelsbläue dieSonnenkraft ungleich iſt. Ungeachtet nicht ange-zeigt wird, wie Herr von Humboldt dieſenGedanken ausgeführt, ſo läßt es ſich doch von ei-nem ſo ſorgfältigen Experimentator erwarten, daßer einen Schatten wird gewählt haben, deſſenDichtigkeit ſich nach der Sonnenhöhe nicht verän- |83| derte. Am leichteſten wäre wohl dieſer Gedankeauszuführen, wenn man zwei Thermometer nebeneinander der Sonne ausſetzte, von denen die Kugeldes einen weiß, die Kugel des andern ſchwarzüberzogen wäre.
3. Ueber die Entbindung des Lichts.
*) Nicht ganz vereinbar mit den Verſuchen desHerrn v. Humboldt’s iſt ein von Achard inder bis 27\( \frac{1}{4} \) Zoll geleerten Glocke der Luftpumpeangeſtellter Verſuch, in welcher das Holz noch ei-nige Tage leuchtete. ( Mèm. de l’Acad. de Berlin,p. 1783, S. 99.) Etwas kann man wohl auf dieſauerſtoffreichere Atmoſphäre des Holzes rechnen,doch verdienen dieſe ſowohl, wie die übrigen Ver-ſuche daſelbſt, nicht vergeſſen zu werden. A. |84| reinigt; damit man aber nicht die Schuld dieſes Ver-löſchens der verdampften phosphoriſchen Säure ge-ben könne, zeigte H. v. H., daß das Holz in atmo-ſphäriſcher Luft, die ſtark damit angeſchwängert war,leuchte. Heiße Luft und heißes Waſſer vernichtendas Leuchten, (zwiſchen 30 bis 32° Reaum. hörtes auf zu leuchten,) im kalten Waſſer leuchtetes lange. In alkaliſcher Auflöſung verſchwindetder Glanz; im Alkohol in 6 Minuten; in allenSäuren 9 bis 12 Minuten nach dem Eintauchen.Herr von Humboldt kann wohl keine concen-trirte Schwefelſäure angewendet haben, denn dieſegreift mit außerordentlicher Schnelligkeit leuchten-des Holz an und färbt es ſchwarz, und die Stelle,worauf man es gießt, ſenkt ſich ſogleich; es wirddadurch als ein Hydro-Carbone mit großem Anthei-le Waſſerſtoff charakteriſirt. Herr von Hum-boldt hat bemerkt, daß das unterirdiſche Gruben-holz nie leuchte; er glaubt dies der Abweſenheitdes Lichts zuſchreiben zu können, und führt einBeiſpiel an einem Bolzen an, deſſen oberer Theilnur ſo weit er dem Lichte ausgeſetzt war, leuchtete.Ich geſtehe aber, daß ich nie Holz, welches fort-dauernd dem Lichte ausgeſetzt geweſen war, phos-phoreſciren geſehen habe, auch Herr Gärtner, *) ein ſorgfältiger Beobachter dieſer Erſcheinungen,fordert ausdrücklich Abweſenheit des Lichts. Nie
*) Scherer’s Journal der Chemie, III. Band, S. 5. A. |85| wird das äußerlich faule Holz leuchten; gemei-niglich muß man bei den Hölzern ein Stück wohl-erhaltenes Holz von dem leuchtenden abreißen,und dieſes, durch das umgebende Holz von demSauerſtoffgas der Atmoſphäre geſondert, kann ſodurch Fäulniß eine Miſchung erhalten, in der esohne vorangehende Temperatur-Erhöhung ver-brennt.
4. Verſuche über das Salpetergas und ſeine Ver-bindungen mit dem Sauerſtoffe.
*) Herr von Humboldt bemerkt in dieſer Ab-handlung, daß einſt eine ſehr waſſerſtoffreiche Luft-art aus einer Grube beim Erkalten Eiſen abgeſetzt,ein andermahl, (über die unterirdiſchen Wetter,S. 182.,) daß er beim Abbrennen vom Waſſerſtoff-gas Zinkkalk gefunden. Dies führt ihn auf dieVermuthung, ob man nicht eben daher das Eiſenableiten könne, das aus Feuerkugeln niederfällt.Eine Beobachtung, die den 12ten November dieſesJahres hier von vielen gemacht wurde, (daß eineFeuerkugel ſich plötzlich in einen breiten bren-nenden Feuerſtreifen auflöſte,) ſpricht ſehr für luft-artige, vielleicht nur mit einer Kruſte Eiſen umge-bene Beſtandtheile, in dieſen Meteoren. A. **) Da ſehr viele franzöſiſche Chemiſten ſich nochimmer dieſes Areometers bedienen, ſo glaube ich,daß es vielen willkommen ſeyn möchte, die Gradedes Beauméſchen Areometers auf die zugehörigenſpeciliſchen Gewichte reduciren zu können. Fol-gende Tabelle giebt zum Behufe dieſer Reduction|88| mit Sauerſtoffgas anſtellte, erhielt er, nach nöthi-ger Reduction, m = 2,82, welches gar ſehr vondem gewöhnlichen 1,72 abweicht. Er vermißteindeſſen hier oft die ſchöne Uebereinſtimmung, an
| Bei 10° Reaum. oder 55° Fahr. entſprechen | |||
| Grade an Beaumé’s AreometerfürSalze. | einemſpeciſiſchenGewichtevon | Grade an Beaumé’s Areometer fürgeiſtige Flüſ-ſigkeiten. | einemſpecifiſchenGewichtevon |
| 0 | 1,000 | 10 | 1,000 |
| 3 | 1,020 | 11 | 0,990 |
| 6 | 1,040 | 12 | 0,985 |
| 9 | 1,064 | 13 | 0,977 |
| 12 | 1,089 | 14 | 0 970 |
| 15 | 1,114 | 15 | 0,963 |
| 18 | 1,140 | 16 | 0,955 |
| 21 | 1,170 | 17 | 0,949 |
| 24 | 1,200 | 18 | 0,942 |
| 27 | 1,230 | 19 | 0,935 |
| 30 | 1,261 | 20 | 0,928 |
| 33 | 1,295 | 21 | 0,922 |
| 36 | 1,333 | 22 | 0,915 |
| 39 | 1,373 | 23 | 0,909 |
| 42 | 1,414 | 24 | 0,903 |
| 45 | 1,455 | 26 | 0,892 |
| 48 | 1,500 | 28 | 0,880 |
| 51 | 1,547 | 30 | 0,867 |
| 54 | 1,594 | 32 | 0,856 |
| 57 | 1,659 | 34 | 0,847 |
| 60 | 1,717 | 36 | 0,837 |
| 63 | 1,779 | 38 | 0,827 |
| 66 | 1,848 | 40 | 0,817 |
| 69 | 1,920 | ||
| 72 | 2,000 | ||
| AbſorbirtesVolumen = z. | Sauerſtoff= y. | Rückſtand. |
| 109° | 0,307 | 91 |
| 108 | 0,304 | 92 |
| 107 | 0,301 | 93 |
| 106 | 0,298 | 94 |
| 105 | 0,295 | 95 |
| 104 | 0,293 | 96 |
| 103 | 0,290 | 97 |
| 102 | 0,287 | 98 |
| 101 | 0,284 | 99 |
| 100 | 0,281 | 100 |
| 99 | 0,278 | 101 |
| 98 | 0,276 | 102 |
| 97 | 0,274 **) | 103 |
| 96 | 0,270 | 104 |
| 95 | 0,267 | 105 |
| 94 | 0,264 | 106 |
*) Im Originale ſteht 0,01, ſo wie überhaupt ſehrviele Zahlen und Nahmen, ja, ganze Perioden, ver-dunkelt ſind. A. **) 0,273. A. |90|
| AbſorbirtesVolumen = z. | Sauerſtoff= y. | Rückſtand. |
| 93 | 0,261 | 107 |
| 92 | 0,259 | 108 |
| 91 | 0,256 | 109 |
| 90 | 0,253 | 110 |
| 89 | 0,250 | 111 |
| 88 | 0,247 | 112 |
| 87 | 0,245 | 113 |
| 86 | 0,242 | 114 |
| 85 | 0,239 | 115 |
| 84 | 0,236 | 116 |
|91|
NACHTRAG zu den vorhergehenden Abhandlungen desHerrn von Humboldt’s. Ueber einige bisher nicht beachtete Ur-ſachen des Irrthums bei Verſuchenmit dem Eudiometer,von L. A. v. Arnim.
*) A. a. O., S. 256.|92| Prieurſchen Verſuche, ( Journ. polytechn. C. II,) *) über die eigenthümliche Ausdehnung der verſchie-denen Gasarten bei gleichen Graden der Wärme, undbeſonders an die ausgezeichnet große Ausdehnungdes Stickgas erinnern. Das Stickgas hat, nachdieſen Verſuchen, in Verhältniß zu der atmoſphäri-ſchen Luft, die es mit dem Sauerſtoffgas haupt-ſächlich zuſammenſetzt, eine größere Ausdehnungs-fähigkeit durch die Wärme, als dieſes. Im Eudio-meter erhalten wir auf verſchiedenen Wegen Stick-gas; das Sauerſtoffgas wird zerſetzt; geſchieht da-her die Unterſuchung einer Luftart nicht bei derſel-ben Temperatur, wo ſie eingeſammelt, ſondern ineiner wärmern, ſo werden alle Unterſuchungen zuviel Stickgas in Verhältniß zum Sauerſtoffgas ange-ben. Es iſt dieſe Bemerkung in mehrerer Rück-ſicht von Einfluß. Zuerſt für die Eudiometrie ſelbſt;nicht etwa bloß wegen der Garnerinſchen Luftun-terſuchung allein, die in der wärmern Pariſer At-moſphäre vorgenommen wurde, ſondern überhauptin Rückſicht aller Eudiometer-Verſuche im Win-ter, die in der warmen Stube angeſtellt werden.Ich weiß nicht, wie Herr von Humboldt ſeinetrefflichen ſalzburger meteorologiſchen Unterſuchun-gen angeſtellt hat, es ſollte mir aber ſehr leid thun,wenn dieſer Schatz von Beobachtungen dadurch an
*) Prony architecture hydraulique, à Paris 1796,T. II, p. 152 — 196.|93| Richtigkeit verlöre. — Für die Meteorologie über-haupt iſt ferner jene Bemerkung von Einfluß, in-dem, nach derſelben, wenn anderweitige Umſtändees nicht hinderten, durch erhöhte Temperatur derAtmoſphäre ihr Sauerſtoffgehalt vermindert erſchei-nen müßte. Wenn man deswegen die Humboldt-ſchen Beobachtungen durchſieht, ſo findet man un-gefähr eben ſo viele, wo dies der Fall war, als woder entgegengeſetzte eintrat. Dem Meteorologenbleibt daher die Unterſuchung, durch welchen Pro-zeß in den entgegengeſetzten Fällen das Sauerſtoff-gas vermehrt wurde. — Der Luftdruck kommt beiEudiometer-Verſuchen, insbeſondere bei ſolchen,wie die Humboldtſchen über eine Luft, in der dasBarometer 4 Zoll niedriger als in Paris ſtand, undwegen der ungleichen Zuſammendrückung der Luft-arten durch gleiche drückende Laſten, in Betracht.Zwar haben wir nur Verſuche, die dieſe Verſchie-denheit beweiſen, ohne Verſuche zu haben, diedieſen Unterſchied beſtimmen; ſo viel iſt aber ge-wiß, daß, je nachdem das Stickgas, welches im Eu-diometer abgeſchieden wird, in Verhältniß zu deratmoſphäriſchen Luft eine größere oder geringereCompreſſibilität hat, durch den größern Luftdruckzu Paris der Sauerſtoffgehalt größer oder geringerangegeben wird. — Die Rechnung des Herrn von Humboldt, (S. 163,) nach welcher der mittle-re Sauerſtoffgehalt der Luft im December viel ge-ringer als im April iſt, widerſpricht der Meinungeiniger Phyſiker, die den größern Reiz der Win- |94| terluft auf die Lungen von größerm Sauerſtoffgehaltederſelben herleiten. Vielleicht, wenn ich nichtirre, ſo wird der Fehleranſchlag für die Eudiome-ter im Winter ihre Meinung wenigſtens in dieſerRückſicht rechtfertigen. Auch dem Aſtronomenkann jene Bemerkung über Hrn. v. Humboldt’s Unterſuchung nicht gleichgültig ſeyn, da, nach Hrn. Kramp, (in ſeiner Analyſe des réfractions aſtro-nomiques, Leipz. 99, S. 29,) die beſte Tafel überdie Strahlenbrechung von Bradley mit der An-nahme einer beſtändigen ſpecifiſchen Elaſticität, wieer ſie nennt, der Luft in jeder Höhe am beſten über-einſtimmt, nach der Analyſe des Herrn von Hum-boldt’s hingegen, dieſe durchaus nicht hätte beſte-hen können. Da die Oxyanthrakometrie mit allemFug einen Platz in der Eudiometrie behauptet, ſo iſtes wohl nicht am unrechten Orte, auf einen Verſuchaufmerkſam zu machen, wodurch die Vermuthungdes Hrn. v. Humboldt’s, (über die unterirdiſchenGasarten, S. 169,) daß es eine überſaure, odervollkommne Kohlenſäure gebe, geprüft werdenkönnte. Man wäge nämlich die Menge von Kalk-erde, die aus dem Kalkwaſſer durch gleiche Vo-lumina von verſchiednen Sorten Kohlenſäu-re niedergeſchlagen wird; denn Säuren, dieman auf ein gleiches ſpecifiſches Gewicht ge-bracht, laſſen ſich am beſten durch die Mengedes zu ihrer Sättigung nöthigen Stoffs unter-ſcheiden. |95| Sollte der Verſuch einen Unterſchied zeigen, ſowäre das Lichtenbergiſche *) Verzeichniß der aufMeter oder Meſſer ſich endigenden Namen umeinen vermehrt, um einen Kohlenſäure-Güte-Prüfungs-Meſſer. Ein nothwendigeres Werkzeugzur Luftprüfung wäre wohl ein Feuchtigkeitsmeſſerder Luft, da die gewöhnlichen Hygrometer, aus be-kannten Gründen, aller von Sauſſüre angewendetenMühe ungeachtet, dies nicht leiſten können. Herrnv. Humboldt’s Vorſchlag, die Flaſchen zu er-wärmen und dann ſchnell zu erkälten, (über un-terirdiſche Gasarten, S. 148,) leiſtet, wenn ich nichtirre, nicht viel mehr, da auch aus der kälteſtenLuft durch Entbindung der Gasarten, (z. B. Fluß-ſäure, ſalzige Säure,) die des Waſſers zu ihrer Dar-ſtellung in tropfbar-flüſſiger Geſtalt bedürfen, Waſ-ſer abgeſchieden wird. Dieſe Luftarten würde ichaber am tauglichſten zu dieſem Geſchäfte der Waſ-ſerabſcheidung finden; gleiche Volumina der zuprüfenden und der prüfenden Luft in dem mitQueckſilber gefüllten Humboldtſchen Eudiometervermiſchen; die Vermiſchung bis zu einem beſtimm-ten Punkte erkälten; und aus der Verminderung desVolumens, nach den dazu nöthigen Erfahrungen,auf den Waſſergehalt ſchließen.
*) Ich glaube immer, daß ſich Experimental-Phy-ſik am beſten nach einem ſolchen Verzeichniſſevon Metern entwickeln ließe. A.